لقد كانت المعلومات عن بناء الزجاج محدودة ، هي أن الزجاج هو مادة غير عضوية وغير متبلورة ذات خواص متجانسة على حين أن بعض الباحثين يعدون الزجاج اما سائل ذي كثافة عالية أو سائل مبرد سريعا الى أن جاءت الدراسات التي أجراها وارن (Warren) بواسطة الأشعة السينية الحيودية ( X.R.D. ) والتي كانت حول ماهية مادة الزجاج حيث أظهرت النتائج أن الزجاج السليكي يكون على شكل مجموعات غير منتظمة مع المواد الصاهرة (القلويات والقواعد) التي تكون منتشرة أو موزعة خلال هذا النظام وهذا النظام أما مترابط (Linked) أو متجسر ( Bridged ) مع ذرات الاوكسجين ومن خلال هذا النظام يُكون الزجاج شكلا بنائيا من نفس الوحدات التي تبني أشكال السليكا المتبلورة . ففي بلورات السليكا كل ذرة سليكون ذات أحداثيات أربعة ذرات أوكسجين في زوايا الذرة الرباعية الأوجه أو هرم رباعي (Tetrahedron) وتعمل كل ذرة أوكسجين كجسر للأرتباط مع ذرتين سيليكون متجاورة كما في الشكل (1) .
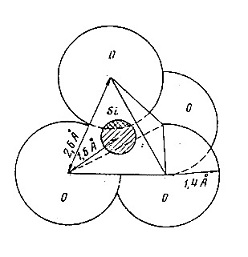
الشكل (1) يبين الشكل البنائي الهرمي الرباعي الأوجه (Tetrahedron) للسليكا (SiO2)
أن التركيب في الزجاج غير منتظم لذا فأن حدوث التبلور فيه غير ممكن ، ففي السليكا الزجاجية يكون تنظيم السليكون – أوكسجين متعدد الاشكال أما في السليكا المتبلةرة يكون ثابت ومستقر .
فالتباعد بين جزئيات السليكا في الزجاج الأعتيادي يكون أكبر مما في السليكا الزجاجية النقية ليضم القلويات والقواعد ، واذا زادت نسبة هذة المواد فأن التباعد يزداد نسبيا .
أن قابلية الاكاسيد التي تكون الزجاج للتفاعل بسهولة تعتمد على القوة الداخلية للذرة (Inter-atonic force) وفي علاقة طردية مع انصاف اقطارها حيث ان صغر نصف القطر يؤدي الى قوة شد الألكترونات في المدارات الخاجية الى نواة الذرة (الجدول -1) مما يؤدي الى صعوبة دخولها سلاسل السليكا .
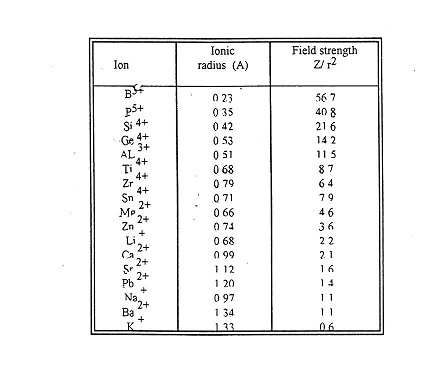
Z = valency, i = ionic radius .
جدول (1) يبين القوة الحلقية للأيونات الموجبة المكونة للزجاج
لايُكون الشبك في الزجاج دورات سلسلسة طويلة ( Long-range ) لذا فأنه لايعطي قمم حادة في فحص الأشعة السينية الحيودية ، أما في البلورات يكون الشبك منظم ذو قمم حادة ، وهذا نتيجة طبيعية لأن الأواصر التي تربط وحدات بناء الزجاج تكون مكسرة (broken-up) بما فيه الكفاية لتسمح فقط لنظام ذو سلاسل قصيرة أو عشوائية والشكل (2) يوضح ذلك .
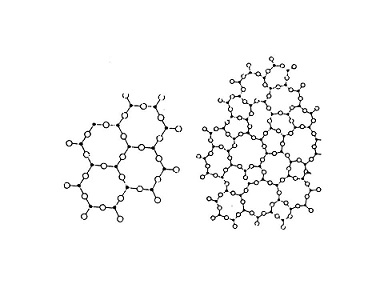
الشكل (2) يبين بناء ( (a السليكا المتبلورة و (b ) السليكا الزجاجية .
أذا فالزجاج السليكي يمتلك شبكة عشوائية لرباعي الأوجة مترابطة من خلال ذرات الأوكسجين – السليكون وعندما يختل نظام هذه الاواصر ، فأن جانب واحد من الثغرة يكون بدون أوكسجين ، أما الجانب الاخر فيكون فيه الأوكسجين بتكافؤ أصري غير مشبع أي تكون هناك فرصة لأكاسيد المعادن الثنائية مثل الكالسيوم CaO لدخول هذه الثغرة لتكمل الترابط لتعطي للزجاج بعض الصلابة .
فتكون الصيغةSi – O –Si = = قد حلت محلها صيغة أخرى هي
= Si – O – Ca – O- Si = والشكل (3) يوضح عملية دخول أيون CO+2 في بنية السليكا .
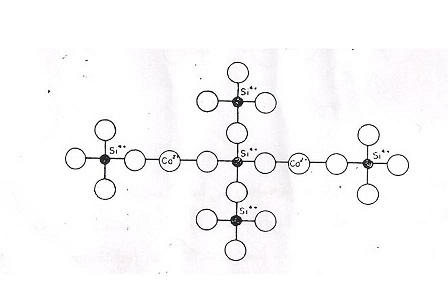
الشكل (3) عملية دخول أوكسيد الكالسيوم CaO
في شبك السليكا
أما أذا دخلت الثغرة أكاسيد قلوية مثل الصوديوم فأن ذرة (Na) مثلا ترتبط مع الاوكسجين غير المشبع في أحد الجوانب بينما Na2O المتبقي يمثل الفراغ في زاوية ذرة السليكون وهنا يظهر Si – O – Na | Na – O – Si وبهذا تكون الثغرات غير المتصلة فيكون البناء ضعيفا بسبب كسر اواصر السليكون – أوكسجين [الشكل (4) يبين كيفية دخول الصوديوم في شبك السليكا] .
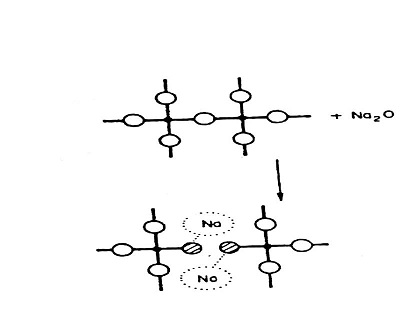
الشكل (4) يبين كيفية دخول الصوديوم في شبك السيلكا .
أما أوكسيد الرصاص ( Pbo ) يدخل في شبك التكوين كأيون ثنائي pb+2 ويعمل كرابط بين أثنين من SiO4من خلال أواصر بين زاويتي الاكسجين )والشكل (5) يبين وضع الرصاص داخل شبك السليكا .
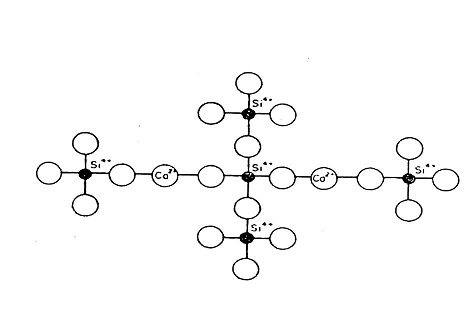
الشكل (5) يبين تواجد أوكسيد الرصاص في شبك السليكا .
أن الأكاسيد القلوية والقواعد عموما تعمل على كسر أواصر السليكا وأضعاف بنائها ومن ثم تخفيض درجة أنصهارها وهذه الاكاسيد تعرف بُمعدلات الشبك (Net work modifiers ) .
أن أوكسيد الألمنيوم AI2O3 وهو من الأكاسيد الوسطية المتعادلة (intermediate oxide) أومكون زجاج مشروط (conditional glass formers) فأن دُخولهُ على الزجاج يكون بأحلال أيون AI+3 محل أيون Si+4 الشكل (6) .
الطبيعة الكهربائية ( Electro – neutrality ) مهمة في حالة دخول أيون موجب قلوي كان أم ترابي حيث أنه يستقر مجاور للشبك في موضع معين ( hole ) ، أذا وجد له مكان بين أثنين من ALO4 الرباعي الأوجه بسبب قوة الأصرة بين أيون AI+3 وأيون الأوكسجين .
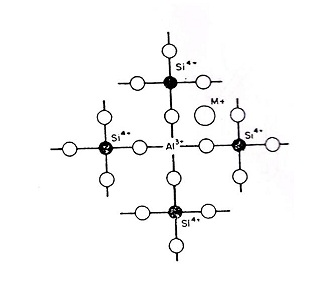
الشكل (6) يبين أسقرار أيون Al +3 محل أيون Si+4 في الشبك
وموقع الأيون القاعدي M+
أما التحول الى الحالة الزجاجية (Glassy state)فيحدث في درجة حرارة معينة يتحول فيها السائل المنصهر الى الحالة الصلبة فاذا مر السائل بتبريد سريع فانهُ ينتقل الى الحالة الصلبة الزجاجية اما اذا كان الانتقال بطيا فقد يؤدي هذا التغيير الى تكون صلب متبلور وهذا يكون مصحوب باختلاف في الحجوم (الشكل – 7) ففي الصلب المتبلور هناك مدى قصير ومدى طويل (short and long range) لتنظيم الجزيئات بينما في حالة السائل ( الزجاج) هناك مدى قصير range) (short فقط لتنظيم الجزيئات في ظروف معينة التغير في الطور من سائل الى صلب لايحدث في درجة حرارة محدودة وأنما بشكل تدريجي ، وأن التحول من صلب الى سائل لايحدث فورا أثناء أرتفاع درجة حرارة محدودة وأي الطورين قد يتغير بشكل غير قابل للتمييز ، ففي درجات محدده وثابتة تعرف بدرجة الأيوتكتيكية ( Eutectic point ) والتي فيها ينصهر السائل الأيوتكتيكي ثم ينصهر الزائد من المركبات الصلبة بأرتفاع درجة الحرارة وأثناء التبريد يتجمد السائل الأيوتكتيكي بعد أن تتجمد النسب الزائدة عنه عندما تصل الى درجة حرارة تجمدها الأعلى من درجة حرارة الأيوتكتيك .
هنالك نقطة أنتقال بين الحالتين السائلة والصلبة تزداد فيها اللزوجة مع أنخفض درجة الحرارة ومن مستحيل تصينف المادة على أنها سائلة أو صلبة.
فالزجاج هو حالة مادة تحتفظ بالطاقة والحجم والترتيب للسائل ولكن التغيرات في الطاقة والحجم مع الحرارة تكون مشابهه في مداها مع تلك التغيرات الحاصلة بالصلب المتبلور .

الشكل (7) يبين الانتقال من الحالة السائلة (1) بالتبريد السريع (2) وصولا الى الحالة الزجاجية (3) , والتحول الى الحالة المتبلورة (4) بعد انخفاض الحرارة Tg – Tƒ .
